Mitte April 2025 wurde Lecanemab als erster Amyloid-β-Antikörper zur Behandlung der frühen Alzheimer Krankheit unter Auflagen in Europa zugelassen.1,2 Ein weiterer Amyloid-β-Antikörper, Donanemab, befindet sich aktuell im Zulassungsverfahren in Europa.3 Die Amyloid-β-Antikörper eröffnen die Perspektive einer ursächlich wirksamen verlaufsmodifizierenden Therapie der Alzheimer-Krankheit. Eingesetzt werden sie bei Menschen mit leichter kognitiver Beeinträchtigung oder Alzheimer Erkrankung im Frühstadium und nachgewiesener Amyloid-β-Pathologie. Patienten und Patientinnen, die mit diesen Therapien behandelt werden, müssen sorgfältig überwacht werden, weil sie amyloid-bedingte Bildgebungsanomalien (ARIA) verursachen können.
Hintergrundinformationen – verlaufsmodifizierende Therapien
Wie eingangs erwähnt, eröffnen die Amyloid-β-Antikörper die Perspektive einer ursächlich wirksamen verlaufsmodifizierenden Therapie der Alzheimer-Krankheit. Eingesetzt werden sie bei Menschen mit leichter kognitiver Beeinträchtigung oder Alzheimer Erkrankung im Frühstadium und nachgewiesener Amyloid-β-Pathologie. Dementsprechend ist für die Behandlungsindikation der Nachweis einer Amyloid-β-Pathologie (durch Liquoruntersuchung oder Amyloid- Amyloid-Positronen-Emissions-Tomographie [PET]) erforderlich, wie es in den Einschlusskriterien der diesen Therapien zugrundeliegenden Phase 3 Studien beschrieben ist.2,4-6 Durch die Behandlung mit diesen Antikörpern, wird Amyloid-β aus dem Gehirn entfernt und der Verlauf der Erkrankung verlangsamt (jedoch nicht vollständig gestoppt oder geheilt). Die Therapien werden per Infusion in zwei- oder vierwöchigen Abständen gegeben.2,4-6 Tabelle 1 fasst die wichtigste Aspekte zu Lecanemab und Donanemab zusammen.
Nutzen-Risiko-Profil der Amyloid-β-Antikörper-Therapien
In den klinischen Studien dienten Skalen, die Kognition, Funktion und Alltagsaktivitäten kombinierten, jeweils als primäre Studienendpunkte. Dafür angewendet wurden z.B. der integrated Alzheimer Disease Rating Scale Score (iADRS) oder die Clinical Dementia Rating Sum of Boxes (CDR-SB). Zusätzlich wurde die Lebensqualität und Belastung der Pflegenden erfasst, oder spezifische Biomarker untersucht unter anderem mit dem Ziel Patientengruppen zu identifizieren, die besonders gut auf die Therapie ansprechen.7 Die Behandlung mit Donanemab bzw. Lecanemab hat bei Patienten mit Alzheimererkrankung im Frühstadium in den Phase 3 Studien zu einer Verbesserung der Kognition und Alltagsfähigkeiten geführt.4,5
Patienten und Patientinnen, die mit Amyloid-β-Antikörper-Therapien behandelt werden, müssen sorgfältig überwacht werden, weil sie amyloid-bedingte Bildgebungsanomalien (ARIA) wie ARIA mit Ödemen/Effusionen (ARIA-E) und ARIA mit Hämosiderinablagerungen/Hämorraghe (ARIA-H) verursachen können (siehe separates Kapitel). ARIA ist in der Regel asymptomatisch, selten kann es jedoch zu schweren und lebensbedrohlichen Ereignissen kommen, insbesondere bei älteren Patienten mit stärker ausgeprägten zerebralen Durchblutungsstörungen und gerinnungshemmender Behandlung. Entsprechend werden in den (verfügbaren*) Fachinformationen Massnahmen zur Verringerung des Risikos für ARIA angegeben.1,6,7
Tabelle 1: Zusammenfassung wichtiger Aspekte zu Donanemab und Lecanemab.
Lecanemab (Leqembi®)1,4,7
Donanemab (Kisunla™)5-7
Antikörper Charakteristika
• Isotyp
• IgG1 humanisiert
• IgG1 humanisiert
• Ziel-Epitop
• N-terminal
• N-terminales Pryoglutamat-Aβ
• Ziel-Amyloid Spezies
• Lösliche Aβ-Aggregate
(Oligomere, Protofibrillen) > unlöslichen Fibrillen)
• Fibrillen /Plaque-assoziiertes Aβ («plaquespezifisch»)
Indikation
Behandlung der frühen Alzheimer Krankheit (MCI, frühe AD) mit bestätigter Amyloid-Pathologie und ApoE ε4 Nichtträger oder heterozygote ApoE ε4-Träger
In Europa aktuell im Zulassungsverfahren.
Applikation und Dosierung
i.v. Infusion alle 2 Wochen 10mg/kg/KG (keine Titration)
i.v. Infusion alle 4 Wochen 1.-3. Dosis jeweils 700 mg, danach 1.400 mg
Phase 3 Studien (N)
Clarity AD (N=1795)
TRAILBLAZER-ALZ 2 (N=1736)
Wirksamkeit
Primärer Endpunkt:
Δ vs. Placebo (% verlangsamt, bereiningt)
Δ CDR-SB (Baseline – 18 Monate) -0,45 (-27%), p<0,0001
Δ iADRS (Baseline – 76 Wochen) -2,92 (-22,3%), p<0,001
Weitere klinische Endpunkte: Δ vs. Placebo (% verlangsamt, bereinigt)
Δ ADAS-Cog14 (Baseline – 18 Monate) -1,442 (-26%), p=0,00065
Δ CDR-SB (Baseline – 76 Wochen) -0,7 (-28,9%), p<0,0001
Δ ADCS MCI-ADL (Baseline – 18 Monate) -2,0 (-37%), p<0,0001
Δ ADAS-Cog13 (Baseline – 76 Wochen)-1,33 (-20%), p=0,0006
Δ ADCOMS (Baseline – 18 Monate) -2,0 (-37%), p<0,0001
Δ ADCS-iADL (Baseline – 76 Wochen) 1,7 (-28%), p<0,0001
Biomarker
Amyloid-Last im PET Δ vs. Placebo (bereinigt)
Δ Baseline – 18 Monate (N=698) −59,12 Centiloide, p<0,0001
Δ Baseline – 76 Wochen −86,4 Centiloide, p<0,0001
Anteil Patienten mit Amyloid-Clearance (<24,1 Centiloids)
Nicht erfasst
Nach 24 Wochen: 29,7% (Placebo 0,2%)
Nach 76 Wochen: 76,4% (Placebo 0,3%)
Sicherheit
Amyloid-bedingte Bildgebungsanomalien (ARIA) gesamt
21,5% (Placebo 9,5%)
36,8% (Placebo 14,9%)
• ARIA-E
• 12,6% (Placebo 1,7%)
• IgG1 humanisiert
• ARIA-H
• 17,3% (Placebo 9,0%)
• N-terminales Pryoglutamat-Aβ
○Mikroblutung
○ 14,0% (Placebo 7,6%)
○ 26,8% (Placebo 12,5%)
○Superfizielle Siderose
○5,6% (Placebo 2,3%)
○ 15,7% (Placebo 3,0%)
○Makroblutung
○ 0,7% (Placebo 0,2%)
○ 0,4% (Placebo 0,2%)
Todesfälle
0,7% (Placebo 0,8%)
Kein Todesfall wurde als therapie- oder ARIA assoziiert, bewertet
1,9% (Placebo 1,1%)
3 (0,4%) im Anschluss an ARIA (Placebo 1 (0,1%) aufgrund von Arteriosklerose)
Infusionsbedingte Reaktionen
26,4% (Placebo 7,4%)
8,7% (Placebo 0,5%)
(traten meist bei der ersten Infusion auf und wurden in den meisten Fällen als mild bis moderat beurteilt)
(traten meist während oder bis 30 Minuten nach der Infusion auf und wurden in den meisten Fällen als mild bis moderat beurteilt)
Bei der nächsten Infusion kann eine Prämedikation mit einem Antihistaminikum, nicht-steroidalen Antirheumatika oder Kortikosteroiden in Betracht gezogen werden.
Bei der nächsten Infusion soll eine Prämedikation mit einem Antihistaminikum, nicht-steroidalen Antirheumatika oder Kortikosteroiden in Betracht gezogen werden.6
Aβ: β-Amyloid; AD: Alzheimer Demenz; ADAS-Cog13: Alzheimer’s Disease Assessment Scale-Cognitive Subscale 13 (Bereich 0–85; höherer Score impliziert stärkere Beeinträchtigung; ADAS-Cog14: ADAS-Cog Subscale 14 (Bereich 0-90; höherer Score impliziert stärkere Beeinträchtigung); ADCOMS: Alzheimer’s Disease Composite Score (Bereich 0-1,97; höherer Score impliziert stärkere Beeinträchtigung); ADCS-iAD: Alzheimer’s Disease Cooperative Study – instrumental Activities of Daily Living (Bereich 0-59, tieferer Score impliziert stärkere Beeinträchtigung); ADCS-MCI-ADL: Alzheimer’s Disease Cooperative Study–Activities of Daily Living Scale for Mild Cognitive Impairment (Bereich 0-53 für Version mit 18 Items und 0-69 für Version mit 24 Items; tieferer Score impliziert stärkere Beeinträchtigung); ApoE ε4: Apolipoprotein E ε4; ARIA: amyloid-related imaging abnormalities (amyloid-bedingte Bildgebungsanomalien); ARIA-E: ARIA with edema or effusions (ARIA mit Ödemen); ARIA-H: ARIA with hemosiderin deposits (ARIA mit Hämosiderinablagerungen); CDR-SB: Clinical Dementia Rating Sum of Boxes (Bereich 0–18; höherer Score impliziert stärkere Beeinträchtigung); Centiloid: die Centiloid-Skala wurde entwickelt, um die Messungen der Amyloid-PET-Bildgebung zu standardisieren8; iADRS: integrated Alzheimer Disease Rating Scale Score (Bereich 0–144; niedriger Score impliziert stärkere Beeinträchtigung); IgG1: Immunoglobulin G, Typ 1; MCI: Mild Cognitive Impairment; PET: Positronen-Emissionstomografie.
Kommentar: Pathologische Prozesse bei der Alzheimer Erkrankung und Targets für Therapieansätze
Patienten mit einer Alzheimer-Erkrankung weisen sowohl extrazelluläre Beta Amyloid-Plaques (Amyloid β) als auch intrazelluläre hyperphosphorylierte Tau-Fibrillen auf. Lange war das vorherrschende Verständnis zur Pathogenese der Alzheimer Krankheit, dass Amyloid β-Veränderungen den Krankheitsprozess auslösen und eine schädliche Kaskade mit Tau-Pathologie und Neurodegeneration in Gang setzen. Über diese „auslösende“ Funktion hinaus wurde in der Regel angenommen, dass Amyloid β und Tau unabhängig voneinander und ohne spezifische Interaktion wirken. Heute gehen wir davon aus, dass Amyloid β die Tau-Pathologie auslöst, wobei es zu komplexen und synergistischen Wechselwirkungen zwischen Amyloid β und Tau kommt, die zum Fortschreiten der Alzheimer-Krankheit führen.9,10
Amyloid β ist das häufigste Ziel von Arzneimitteln in später klinischer Entwicklung (Phase 2 oder 3) oder in der Zulassungsphase. Durch die Beseitigung von Amyloid-β-Oligomeren (lösliche Aggregate von Amyloid-β) und Plaques (unlösliche extrazelluläre Aggregate von fibrillärem Amyloid-β) mit monoklonalen Antikörpern soll das Fortschreiten der Krankheit verlangsamt werden können. Therapien in klinischer Entwicklung nutzen teils auch andere pathogenetischer Aspekte der Alzheimer Krankheit (z.B. Neurogenese, Inflammation oder oxidativer Stress), sie umfassen traditionelle kleine Moleküle (z. B. Enzyminhibitoren), Immuntherapien (neben den monoklonalen Antikörpern beispielsweise aktive Vakzinierung), genbasierte Ansätze (z.B. Antisense-Oligonukleotide, ASO) oder nicht pharmakologische Interventionen wie Low-dose-Strahlentherapie oder stammzellbasierte Therapien.7
Amyloid-assoziierten Bildgebungsanomalien (ARIA)
Patientinnen und Patienten, die mit Amyloid-β-Antikörper-Therapien behandelt werden, können amyloid-bedingte Bildgebungsanomalien (ARIA) wie ARIA mit Ödemen/Effusionen (ARIA-E) und ARIA mit Hämosiderinablagerungen/Hämorraghe (ARIA-H) entwickeln und müssen entsprechend sorgfältig überwacht werden.
Natürliches Vorkommen von ARIA:
Während ARIA-E im natürlichen Verlauf der Alzheimer Demenz vereinzelt beobachtet wurden (< 1 %), sind spontane Mikroblutungen (Mikrohämorrhagien und superfizielle Siderose) deutlich häufiger und auch in der Allgemeinbevölkerung ist eine altersabhängige Prävalenz nachweisbar (gemäß einer populationsbasierten Studie aus Rotterdam: ~18 % bei 60–69-Jährigen und ~38 % bei Über-80-Jährigen).7,11,12
Klassifizierung von ARIA:
ARIAs werden in verschiedene Schweregrade eingeteilt, wobei diverse Skalen existieren. Eingeteilt werden ARIAs basierend auf Magnet-Resonanz Tomographie (MRT)-Charakteristika (z. B. Ausdehnung/Anzahl bzw. Lokalisation). Die Zulassungsbehörden* wenden dazu ein dreistufiges Schema (leicht, moderate, schwergradig) an (siehe Tabelle 2).1,6,7
Merkmale von ARIA
Die Merkmale für ARIA können wir folgt umschrieben werden:
- ARIA-E/H sind überwiegend klinisch asymptomatisch und treten meist in frühen Therapiephasen auf. In den klinischen Studien bildeten sich ARIA-E typischerweise nach Dosisanpassungen, Therapiepausen oder -abbruch (je nach Studienprotokoll) spontan zurück und waren nach drei bis vier Monaten im MRT nicht mehr nachweisbar. Möglich ist jedoch ein wiederholtes Auftreten nach Therapiefortsetzung (Ausgangs- oder reduzierte Dosis), was in ~14–26 % der Fälle beobachtet wurde.7,13
- In symptomatischen Fällen (~6–39 % abhängig von Dosis und Medikament) war die assoziierte Klinik meist leicht oder moderat. Häufige Symptome waren Kopfschmerzen, Verwirrtheitszustände, Übelkeit/Erbrechen sowie Gang- und Sehstörungen.7,11,13,15
- In seltenen Fällen führte ARIA zu einer schwerwiegenden Klinik (z. B. epileptische Anfälle, Enzephalopathie, Stupor) mit notwendiger Hospitalisierung oder intensivmedizinischer Behandlung, wobei vereinzelt empirisch und analog zu entzündlichen Formen der zerebralen Amyloid-Angiopathie (CAA) mit intravenösen Glukokortikoiden therapiert wurde.7,15-17
Tabelle 2: Charakteristika von amyloid-assoziiertem Bildgebungsanomalien
ARIA-E
Beschreibung 18,19
Ödem

Effusion
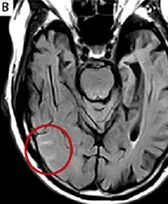
Parenchymales Ödem (ARIA-E) im linken Parieto-Occipital-Lappen (T2-Flair)*18
Leptomeningeale Effusion (ARIA-E) in mehreren Sulci im rechten Temporo-Occipital-Lappen (T2-FLAIR) (ausgefüllter Kreis)*18
Art / Ort der Leckageprodukte 20
Austritt von intravaskulärer Flüssigkeit und Proteinen in das interstitielle Flüssigkeitskompartiment des Parenchyms
Austritt von proteinhaltiger Flüssigkeit in den leptomeningeale /subarchnoiden Raum
MRT-Charakteristika 7
hyperintens in FLAIR
DWI-Negativ (Differenzialdiagnose: zytotoxisches Ödem)
keine Kontrastmittelaufnahme ggf. mit lokoregionalem Masseneffekt/ gyraler Schwellung
Radiologische Einteilung nach Schweregrad 1,7,20
definiert durch Größe und Anzahl der Foci (sulcal/kortikal oder subkortikales Marklager)
• leicht:
< 5 cm und unifokal
• moderat:
5–10 cm + unifokal oder
< 10 cm + multifokal
• schwer:
> 10 cm und uni- oder multifokal
ARIA-H
Beschreibung 18,19
Mikroblutung

Superfizielle Siderose
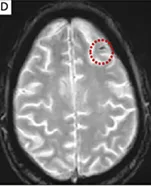
Mikroblutungen (ARIA-H, punktförmige Herde von Signalleere auf GRE/T2*) in einem Gebiet mit Parenchymödem (ARIA-E) (gestrichelter Kreis)*18
Oberflächliche Siderose, d. h. eine kleine leptomeningeale Hämosiderinablagerung (ARIA-H), im linken Frontallappensulkus (gestrichelter Kreis)*18
Lobäre Makroblutungen treten bei der Anwendung von Anti-Amyloid-Antikörpern nur selten auf, und wenn doch, kann sie das Ergebnis eines zugrunde liegenden Krankheitsprozesses wie eine zerebrale Amyloid-Angiopathie sein.19
Art / Ort der Leckageprodukte 20
Austritt von Blutabbauprodukten in das angrenzende Hirnparenchym
Austritt von Blutabbauprodukten in den Subarachnoidalraum
MRT-Charakteristika7
Hypointens in GRE/T2*w
SWI hypointens
Cave: meist nicht sichtbar in CT, T1/T2/FLAIR/DWI; einheitliche MRT-Blutungssequenz empfohlen
Radiologische Einteilung nach Schweregrad 1,7,20
Anzahl neuer Mikroblutungen bzw. Areale mit SS (unabhängige Evaluation beider Entitäten)
• leicht:
≤ 4 neue Mikroblutungen/1 Areal mit superfizieller Siderose
• moderat:
5–9 neue Mikroblutungen/2 Areale mit SS
• schwer:
≥ 10 neue Mikroblutungen bzw. > 2 Areale mit superfiziellen Siderosen
AD: Alzheimer’s Disease, ARIA-E: Amyloid-bedingte Bildgebungsanomalien – Ödeme/Effusionen; ARIA-H: Amyloid-bedingte Bildgebungsanomalien – Hämorrhagie/Hämosiderinablagerungen; CT: Computertomogramm; DD: Differenzialdiagnose; DWI: diffusionsgewichtete Bildgebung; FLAIR: fluid attenuated inversion recovery; GRE: Gradient-Echo-Sequenz; MRT: Magnet Tomographie; T2*w: T2*-gewichtete Bildgebung; SWI: suzeptibilitätsgewichtete Bildgebung
Pathomechanismus von ARIA
Der genaue Pathomechanismus hinter der Entwicklung von ARIA ist Gegenstand aktueller Forschung. Zwei Mechanismen wurden postuliert. Beide basieren auf der Bindung der Anti-Amyloid-β-Antikörper an Amyloid β-Ablagerungen an der Gefäßwand oder im Hirnparenchym und enden mit dem Verlust der Integrität der Gefäßwände infolge erhöhter Permeabilität bzw. Extravasation von proteinhaltigen Flüssigkeiten (ARIA-E) oder Hämprodukten (ARIA-H).7 Zum einen wird angenommen, dass der Abbau von parenchymatischen Amyloid-Plaques zur Mobilisierung größerer Mengen löslicher Amyloid-β-Spezies führt und diese eine vorübergehenden Überlastung der perivaskulären Drainagekapazitäten verursacht, woraus vaskulärer Ablagerung entstehen könnten (ähnlich wie bei einer zerebralen Amyloid-Angiopathie, CAA). Zum anderen begünstigen möglicherweise direkte antikörper-vermittelte inflammatorische (perivaskuläre) Prozesse den Zusammenbruch der Blut-Hirn-Schranke (ähnlich wie bei einer Amyloid-β-assoziierten Angiitis, ABRA). Das Ausmaß der vaskulären Permeabilitätserhöhung ist abhängig von der Schwere der bereits präexistenten Amyloid-Angiopathie, der Effizienz des antikörper-vermittelten Amyloid-Abbaus und der induzierten lokalen Entzündungsreaktion.7
In den klinischen Studien wurde eine Abnahme der ARIA-Inzidenz bei Therapiefortsetzung beobachtet. Präklinische Daten lassen vermuten, dass dies durch eine Reduktion vaskulärer Amyloid-Ablagerung mit resultierender Reorganisation der Gefäßwand und durch Wiederherstellung effektiver perivaskulärer Drainagemechanismen erklärbar sein könnte.7
APOE ε4 und weitere Risikofaktoren für die Ausbildung von ARIA
Die ε4-Variante des Apolipoprotein E (APOE ε4) wurde als einer der Hauptrisikofaktoren für die Ausbildung von ARIA identifiziert und gilt gleichzeitig als das primäre Suszeptibilitätsgen der Alzheimer-Demenz.7 APOE ε4 soll (unabhängig vom Vorhandensein der Alzheimer Demenz-definierenden Pathologien) zu einer Desintegrierung und zum beschleunigtem Zusammenbruch der Blut-Hirn-Schranke führen, das CAA-Risiko erhöhen und ist mit einer größeren Gesamtamyloid-Last (vaskulär und parenchymal) assoziiert.7
Das Risiko für das Auftreten von ARIA unter einer Amyloid-β-Antikörper-Therapien ist geringer bei APOE ε4 Nicht-Trägern im Vergleich zu heterozygoten Trägern und am höchsten bei homozygoten Trägern. Bei ARIA-E wurde neben dem APOE ε4-Genotyp, die Anzahl der Mikroblutungen, das Vorhandensein einer superfiziellen Siderose und ein erhöhter mittlerer arterieller Druck (vor allem ≥ 107 mmHg) mit einem vermehrten ARIA-Auftreten assoziiert. Hingegen scheinen die Geschwindigkeit und das Ausmaß der Amyloid-Reduktion kein treibender Faktor für ARIA zu sein.7
Zur Detektion von ARIA werden MRT-Bildgebungen zu definierten Zeitpunkten sowie ergänzend außerplanmäßig bei klinischem Verdacht empfohlen, wobei sich das anschließende Management je nach radiologischer Schwere und assoziierter klinischer Symptomatik, wie in unterscheidet.7 Therapiespezifische Informationen werden in den Kapiteln zu den Medikamenten zusammengefasst.
*Für Donanemab beziehen wir uns bei dieser Aussage auf die englische Fachinformation6